Es geht um das Thema Atomphysik, Skript: RadioaktiverZerfall.pdf (0,1 MB)
Aufgaben:
1) Definiere die Begriffe Zerfallsreihe, Halbwertszeit und das Zerfallsgesetz.
2) In der Natur existieren viele radioaktive Stoffe. Die Abbildung zeigt die Thorium-Reihe. Das auf der Erde vorkommende Thorium zerfällt in mehreren Stufen bis zum stabilen Blei.
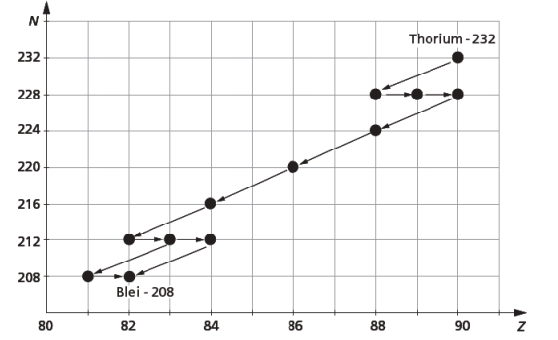
2a) Trage an der horizontalen Achse die Kurzsymbole der betreffenden chemischen Elemente ab!
2b) Wie lauten die Reaktionsgleichungen fur die ersten drei Kernumwandlungen?
2c) Gib zwei Reaktionsgleichungen an, bei denen das stabile Blei-208 entsteht!
3) Ein radioaktives Isotop hat eine Halbwertszeit von 17 Minuten. Berechnen Sie mit Hilfe des oben angegebenen Zerfallsgesetzes wie viele Atome innerhalb von einer dreiviertel Stunde zerfallen sind, wenn zu Beginn 1020 Atome vorhanden waren.
Ansatz:
2a) Thorium
23290Th
Blei
20782Pb
3.)
$$ N ( t ) = N _ { 0 ^ { * } } \left( \frac { 1 } { 2 } \right) ^ { \frac { t } { T _ { 1 / 2 } } } \\ N ( t ) = 1020 * \frac { 1 } { 2 }^{\frac{2700s}{0.283333s}}$$